一、MALDI-TOF
基质辅助激光解吸附质谱技术(Matrix-Assisted Laser Desorption/ Ionization Time of Flight, MALDI-TOF)的基本原理是将分析物分散在基质分子中并形成晶体,当用激光照射晶体时,由于基质分子经辐射所吸收的能量,导致能量蓄积并迅速产热,从而使基质晶体升华,致使基质和分析物膨胀并进入气相。MALDI所产生的质谱图多为单电荷离子,因而质谱图中的离子与多肽和蛋白质的质量有一一对应关系。MALDI产生的离子常用飞行时间(TOF)检测器来检测, 理论上讲,只要飞行管的长度足够,TOF检测器可检测分子的质量数是没有上限的, 因此MALDI-TOF质谱很适合对蛋白质、多肽等生物大分子的研究。
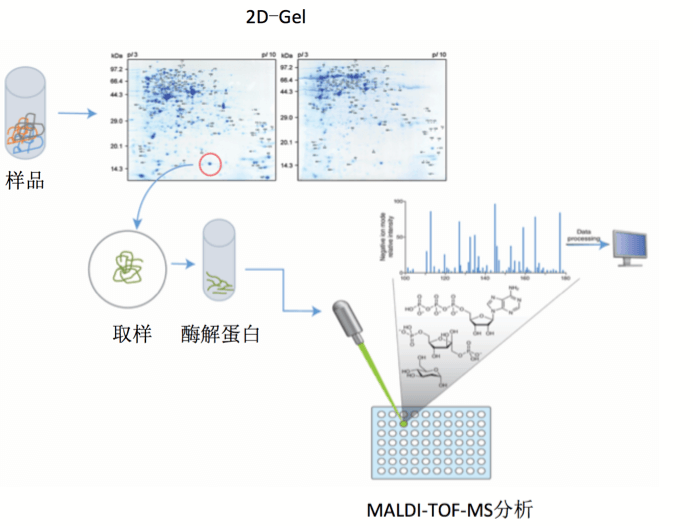
技术特点
• MALDI-TOF 鉴定方便、快速,可以同时做上百个斑点
• 主要用于纯蛋白或简单样本的鉴定,如2DE斑点
• 成本较低
样品要求
• 蛋白质溶液:纯度> 90%;蛋白质总量> 5 ug,浓度> 0.1 ug/ul
• 双向凝胶电泳点:考染、银染点清晰可见
• SDS-PAGE胶条:单一蛋白质,考染、银染条带清晰可见
二、ESI-MS
电喷雾电离质谱(electrospray ionization mass spectrometry,ESI-MS)是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子,使质量电荷比降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。

技术特点
• 高通量:一次可鉴定数十至数百种蛋白质
• 灵敏度高:可检测样品浓度极低的胶点
• 通用性强:可分析蛋白质条带、免疫共沉淀洗脱液、组织提取液、全细胞裂解液、亚细胞分离组分等多种形式的样品
样品要求
• 蛋白质溶液:蛋白质总量>5 ug,浓度>0.1 ug/ul。缓冲液中不含去污剂NP40、Triton X-100等。
• SDS-PAGE胶条:考染、银染条带清晰可见。
制备质谱检测样品注意事项:
• 样本制备过程应避免各类污染和反复冻融
• 配胶和切胶避免角蛋白污染,配胶试剂专用,切胶刀具使用干净一次性的
• 蛋白考染,一般肉眼可见的量都是可以被质谱鉴定到的
• 银染的蛋白质不能使用戊二醛作为固定剂,因为戊二醛使蛋白质发生不可逆交联,会影响质谱鉴定结果
质谱技术的应用
1. 蛋白质纯度分析以及分子量测定
MALDI-TOF是一种软电离技术,可用于检测目标蛋白或多肽是否存在,有无二聚体存在,以及进行纯度情况的大体评估。MALDI-TOF鉴定分子量范围也非常广,能够鉴定700-60000Da的蛋白分子量,准确度高达0.1%~0.01%,远远高于目前常规应用的SDS电泳与高效凝胶色谱技术。
2. 蛋白指纹谱鉴定(PMF)
肽质量指纹谱(Peptide Mass Fingerprinting, PMF)是蛋白质被识别特异酶切位点的蛋白酶水解后得到的肽片段的质量图谱。由于每种蛋白的氨基酸序列(一级结构)都不同,当蛋白被水解后,产生的肽片段序列也各不相同,因此其肽质量指纹图也具有特征性。将肽谱图与数据库中蛋白质理论太谱图对比,从而鉴定蛋白质的身份。因此,分子质量的精确度是PMF的关键指标所在,但蛋白质的翻译后修饰可能使PMF的质量数与理论值不符,从而对蛋白鉴定的准确度有一定影响。
3. MS/MS串联质谱法测序
串联质谱法(MS/MS),是目前常用的质谱鉴定方式。MS/MS先通过一级质谱测定肽段质量,再选取丰度高的肽段进行二级质谱分析,在二级质谱中肽段相互碰撞导致氨基酸键断裂,产生肽段碎片离子经由检测器分析,从而得到筛选肽段的氨基酸序列信息。MS/MS利用丰富肽段碎片的精确质量信息,更具有特异性、可信度,极大地增加了数据库检索的可靠性。

