文章导读
• 单一蛋白质样品的分离、纯化?
• 单一蛋白质的质谱鉴定?
• 蛋白质混合物质谱鉴定方法?
对于单一蛋白的常用鉴定方法,大家肯定立马想到免疫印迹法(Western Blot)。Western Blot是通过抗体和目标分子的特异性结合从而对目标蛋白进行鉴定,但是这种方法是适用于对已知蛋白进行鉴定,并且必须借助抗体,所以不适用于对未知或者没有相应抗体的蛋白进行分析。那么小伙伴们可能要问了,如果自己要研究的蛋白质是未知的或者目前没有可用抗体怎么办呢?在这种情况下,就可以借助质谱鉴定技术来对蛋白质进行鉴定了。在这期中小编就给大家整理了蛋白质鉴定的相关知识,希望对于蛋白质鉴定一直有困惑的同学能有帮助。
一、单一蛋白质分离纯化
提到单一蛋白样品,顾名思义在这类蛋白样品应该已经经过了一定的蛋白纯化步骤,获得了相对单一的蛋白。通常通过细胞裂解或者体外合成的蛋白质都包含其他的杂蛋白,因此需要将目的蛋白与杂蛋白区分开,常用的蛋白分离纯化方法便是电泳分离。一维电泳分离利用蛋白质大小不同的特性,能够很好的将不同分子量的蛋白进行区分,另外,再次基础之上二维电泳能够进一步将不同带点量的蛋白分子进行区分。
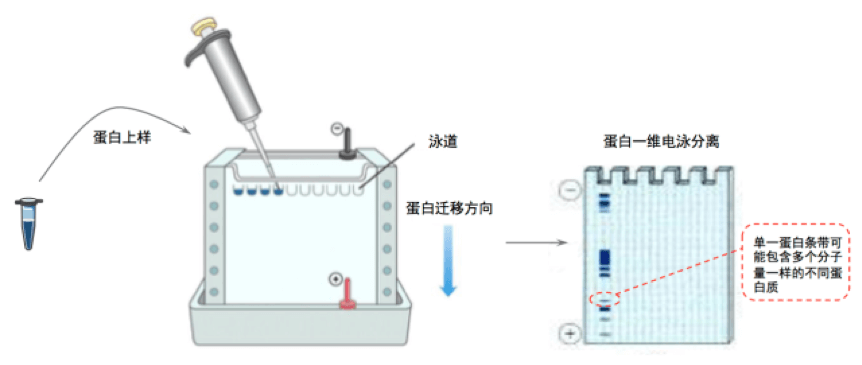
1. 一维电泳
目前普遍采用的一维电泳为垂直板聚乙烯酰胺凝胶电泳(SDS-PAGE胶),其原理是不同浓度的乙烯酰胺在聚合后会产生具有一定孔径大小的凝胶,接着在缓冲液中加入SDS表面活性剂中和蛋白质表面的电荷,当变性的蛋白质混合样品通过凝胶空隙的时候,不同分子量大小的蛋白质在凝胶中迁移的速度不同因而被分离开来。一维电泳能够分离对大多数蛋白和蛋白质复合物进行初步分离。
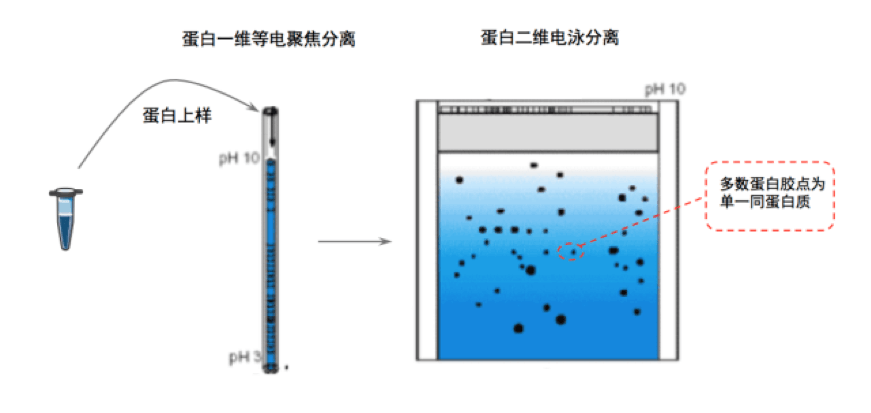
2. 二维电泳
二维电泳,也称为双向电泳,是在一维电泳的基础上加入了横向的等电聚焦分离,而其纵向的分离与一维SDS分离方法完全一样。二维电泳首先利用蛋白等电点不同的特性,对蛋白进行初步分离,接着再根据蛋白质分子量不同,再进一步对等电点相同或相近的蛋白质进行二维分离,进一步提升蛋白质分离效率。二维电泳的蛋白分辨率相比一维电泳已经大幅度提升,经过二维电泳分离后大部分蛋白质都能够被分离为含有单一的蛋白质蛋白胶点。
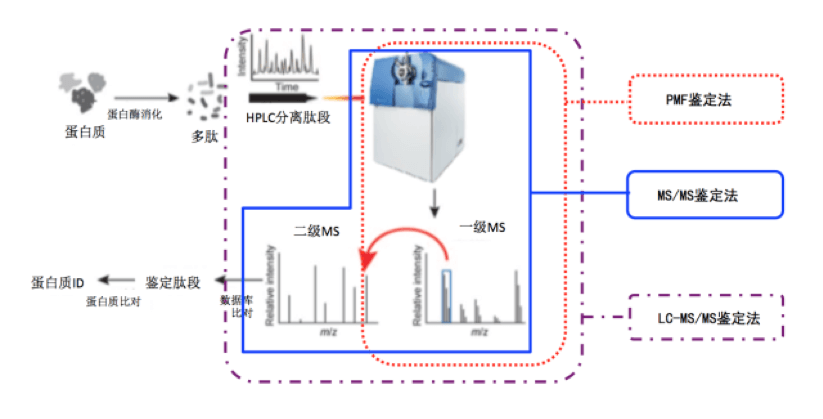
二、单一蛋白质鉴定
目前对纯度较高,或单一蛋白质的鉴定的方法有蛋白质指纹谱鉴定(PMF)和MS/MS串联质谱鉴定蛋白法。这两种方法都是先将蛋白质酶切成多肽片段,再利用质谱仪对肽段分析,达到对蛋白质鉴定的目的。而两种方法的不同之处就在于PMF法只使用一级质谱对蛋白肽段进行检测,而MS/MS不仅经过一级质谱检测,并且在此基础上选取特定肽段进行肽段破碎,对肽段的序列进行测定。因此MS/MS比PMF的鉴定准确度更高,与数据库比对的可靠性更高,但分析起来的也更为复杂。
1. 蛋白质指纹谱鉴定(PMF) 由于蛋白质序列的不同,因此不同的蛋白质在同一种消化酶的作用下酶切产生的多肽片段大小质量是特异的。蛋白质指纹谱鉴定法正是利用了每种蛋白酶切产生的太片段不同的特性,对纯化的蛋白质进行酶切处理,再对酶切产生的肽片段的质量进行分析,即可获得蛋白质的肽质量谱图。再将肽谱图与数据库中蛋白质理论肽谱图进行比对,进而可获知蛋白质的身份信息。
2. MS/MS串联质谱法 串联质谱(MS/MS)检测蛋白的原理是先使用一级质谱检测肽段的质量信息,再选取峰值高的肽段进行破碎,分析获得二级质谱。用检索软件选择相应的数据库对质谱数据进行分析,同时以打分的形式评判鉴定结果,当打分大于某个阈值时,即判定质谱鉴定成功,反之则鉴定失败。
三、蛋白混合物鉴定
虽然目前有多种蛋白质分离纯化的方法,但在很多时候分离效率不够高,导致分离后的蛋白可能还是含有多个蛋白。另外,对于丰度较低的蛋白质可能在分离过程中造成进一步损失而无法被鉴定到,因此需要直接对这一类蛋白质不经过分离处理直接进行分析。目前适用于对混合蛋白进行分析的方法有LC-MS/MS色谱质谱串联分析法。与PMF法和MS/MS法相比,LC-MS/MS在质谱分析前加了液相色谱的分离,使得蛋白分析精度更高,对肽段序列测定几乎可以的达到100%的准确度。因此,与单个蛋白质胶带的鉴定相比,这项服务的可以鉴定的蛋白数量也更多。LC-MS/MS可以用于鉴定200个蛋白质左右的蛋白混合物样品,包括免疫沉淀样品,Pull-down样品等。