目前较主流的定量蛋白质组学方法有5种,分别是Label-free、iTRAQ、SILAC、MRM(MRMHR)、和SWATH。
I. Label-free
Label-free,即非标记的定量蛋白质组学,不需要对比较样本做特定标记处理,只需要比较特定蛋白肽段在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。
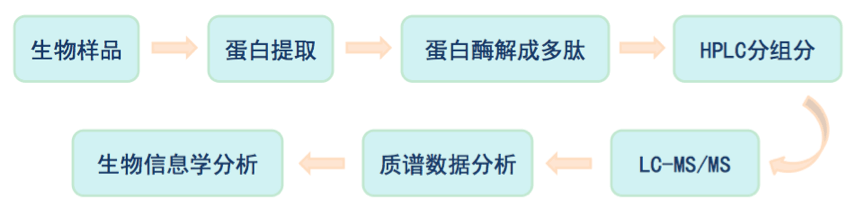
Label-free定量方法操作简单,可以做任意样本的总蛋白质差异定量,但对实验操作的稳定性、重复性要求较高,准确性也较标记定量差。因此,Label-free技术适合于大样本量的定量比较,以及对无法用标记定量实现的实验设计。
II. iTRAQ
同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ) 技术由AB SCIEX公司研发的一种体外同种同位素标记的相对与绝对定量技术。该技术利用多种同位素试剂标记蛋白多肽N末端或赖氨酸侧链基团,经高精度质谱仪串联分析,可同时比较多达8种样品之间的蛋白表达量,是近年来定量蛋白质组学常用的高通量筛选技术。
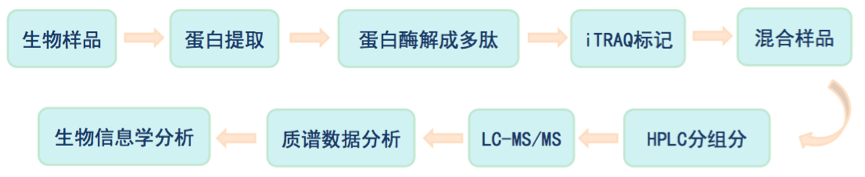
iTRAQ定量不依赖样本,可检测出较低丰度蛋白,且定量准确,可同时对8个样本进行分析,适用于研究不同病理条件下或者不同发育阶段的组织样品中蛋白质表达水平的差异。
III. SILAC
SILAC即细胞培养条件下稳定同位素标记技术(Stable Isotope Labeling By Amino Acids In Cell Culture, SILAC),其实验流程是在细胞培养基中加入轻、中或重型稳定同位素标记的必需氨基酸(赖氨酸和精氨酸),通过细胞的正常代谢,使新合成的蛋白带上稳定同位素标签。等量混合各类型蛋白质,酶解后进行质谱分析。通过比较一级质谱图中同位素峰型的面积大小进行相对定量,同时二级谱图对肽段进行序列测定从而进行蛋白鉴定。
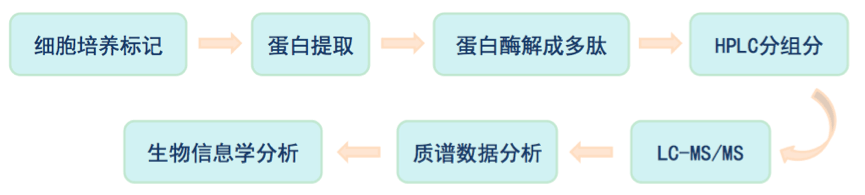
SILAC属于体内标记技术,更接近样品真实状态,标记效率高达100%,且标记效果稳定,适合于全细胞蛋白分析,以及膜蛋白的鉴定和定量,每个样本只需要几十微克的蛋白量。
IV. MRM
MRM是一种基于已知信息或假定信息设定质谱检测规则,对符合规则的离子进行信号记录,去除大量不符合规则离子信号的干扰,从而得到质谱信息的一种数据获取方式,属于目标蛋白质组。关键在于首先要能够检测到具有特异性的母离子,只将选定的特异性母离子进行碰撞诱导,从而去除其他子离子的干扰,只对选定的特异离子进行质谱信号的采集。
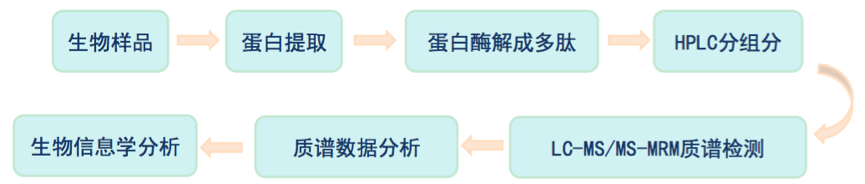
MRMHR技术通过两级离子选择,排除大量干扰离子,使质谱的化学背景降低,目标检测物的信噪比显著提高,从而实现检测的高灵敏度,并具有重现性好、准确度高等特点,特别适合于已知蛋白质序列的蛋白质表达量差异验证,可以检测较低丰度的蛋白,但一次MRM实验只能检测到20个左右的目标蛋白。
V. SWATH
SWATH是瑞士苏黎世联邦理工学院的Ruedi Aebersold 博士及其团队与AB-SCIEX于2012年联合推出的一项全新的质谱采集模式技术,是 MS/MSALL技术的一种扩展。与传统的shot-gun技术相比,SWATH采集模式能够将扫描区间内所有的肽段母离子经过超高速扫描并进行二级碎裂,从而获得完整的肽段信息,是一种真正全景式的、高通量的质谱技术。
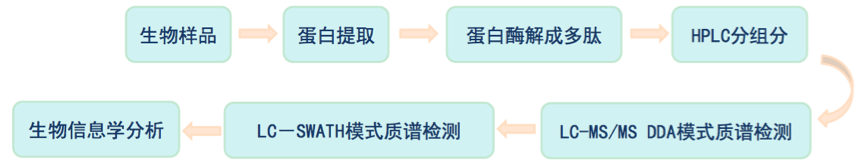
如何选择适合定量蛋白组学分析方法?
比较流行的是iTRAQ定量蛋白质组学方法,该方法不依赖样本,可以做任意样本的总蛋白质的差异定量,而且定量准确。虽然Label-free同样不限定样本,但是定量准确度难以保障。SILAC是细胞层次的蛋白质组定量,而对组织的定量难度较大,并且SILAC培养费用高昂,不适合做商业化。MRM和SWATH都是目标蛋白质组相关的定量模式,但是SWATH可以完成数千种蛋白的定量,准确度极高,通量远高于MRM,对于亚细胞结构、细菌、真菌、细胞分泌物等样本,SWATH效果非常好,但SWATH价格相对较高。

